Vitamin D und seine Wirkung bei Krebs
Neue Studien legen nahe, dass Vitamin D eine wichtige Rolle bei Krebserkrankungen spielt und zwar in gleich mehrfacher Hinsicht.
Vorbeugung
Mit steigenden Vitamin-D-Spiegeln sinkt das Risiko diverser KrebserkrankungenBehandlung
Gute Vitamin-D-Spiegel während der Behandlung gehen mit erhöhten Überlebenschancen und einem besseren Krankheitsverlauf einher.
Vitamin D ist darum eines der großen Themen der aktuellen Krebs-Forschung. Die Anzahl der Studien zum Thema hat in den letzten Jahren fast exponentiell zugenommen und dazu geführt, dass die Mechanismen und Zusammenhänge immer besser verstanden werden.
Dieser Artikel fasst den aktuellen Forschungsstand zusammen und gibt Empfehlungen zur Krebs-Prävention mit Vitamin D.
Die Forschung zu Vitamin D und Krebs
Begonnen hat die Erforschung des Zusammenhanges von Vitamin D und Krebs mit der Entdeckung, dass Krebserkrankungen in sonnenarmen Regionen sehr viel häufiger auftreten und um so seltener werden, je näher man dem Äquator kommt. Dieser Zusammenhang zeigt sich in über 100 Ländern und bei über 15 verschiedenen Formen von Krebs. [1]
Ausgehend von dieser Beobachtung lag der Verdacht nahe, dass sich dieser Zusammenhang durch die erhöhte Vitamin-D-Produktion in sonnenreichen Regionen erklären lässt. Ein Vitamin-D-Mangel könnte also ein wichtiger Risikofaktor für Krebs sein.
Diese Vermutung wird heute durch viele weitere Beobachtungen gestützt:
|
Vitamin D bei Krebs – hohe Erwartungen
All diese Ergebnisse sprechen stark für eine zentrale Rolle von Vitamin D bei Krebs, dennoch bleibt das Thema umstritten. Denn die Studienlage ist derzeit schwer zu deuten, was vor allem daran liegt, dass der Zusammenhang von Krebs und Vitamin D eine Gleichung mit vielen Variablen ist: Die Rolle der Vitamin-D-Versorgung in den Jahren vor der Krebs-Erkrankung, Wechselwirkungen mit anderen Risikofaktoren, genetische Unterschiede in der Vitamin-D-Verwertung, die richtige Dosierung zur Krebs-Prävention – alle diese Dinge müssen derzeit noch in Langzeitstudien untersucht werden. Die bisherige Forschung ist noch immer zu lückenhaft, um definitive Schlüsse ziehen zu können.
Der Vitamin-D-Forscher Daniel Bikkle fasst den Forschungsstand wie folgt zusammen:
„Die randomisierten Studien waren im Allgemeinen fehlerhaft in der Ausführung oder zu klein, um überzeugende Beweise für oder gegen Vitamin D zu liefern. Im Gegensatz dazu waren alle Tierversuche geschlossen positiv und zeigten, dass Vitamin D und/oder sein aktiver Metabolit 1,25 Dihydroxyvitamin D (1,25 (OH)2 D) in einer Vielzahl von Tiermodellen die Entstehung vieler Krebsarten verhindern und/oder diese auch behandeln kann. Weiterhin wurde gezeigt, dass 1,25 (OH)2D eine ganze Reihe von zellulären Mechanismen beeinflusst, die seine Antikrebswirkungen erklären würden.
So gibt es ein Dilemma: Tier- und zelluläre Studien unterstützen eine Rolle von Vitamin D in der Prävention und Behandlung von Krebs, aber entsprechende klinische Studien haben für die meisten Krebsarten noch keine zwingenden Beweise geliefert. […]
Die Beziehung zwischen Krebs und Vitamin D bleibt umstritten. Angesichts des Mangels an pharmazeutischer Unterstützung für hinreichend große Studien dürfte es auch schwierig bleiben, solche Beweise in naher Zukunft in der aktuellen Finanzierungsumgebung zu erbringen. Auf der anderen Seite haben Studien mit Tiermodellen verschiedener Krebserkrankungen einhellig einen klaren Nutzen für Vitamin D […] beweisen können.“[2]
Wie Bikkle vermuten heute die meisten Vitamin-D-Experten, dass die fehlenden klinischen Beweise auf bekannte Fehler in den entsprechenden Studien zurückzuführen sind und gehen davon aus, dass sich die beeindruckenden Ergebnisse aus den Zell- und Tierstudien durchaus auf den Menschen übertragen lassen. Vor diesem Hintergrund befürworten und empfehlen heute viele Forscher den Einsatz von Vitamin D zur Prävention und Behandlung von Krebs.
Bei welchen Formen von Krebs hilft Vitamin D?
Vitamin D wurde in Verbindung mit ganz verschiedenen Krebserkrankungen untersucht. Die jeweilige Studienlage ist je nach Krebsform unterschiedlich gut.
Gute Ergebnisse existieren für:
- Darmkrebs
- Brustkrebs
- Lungenkrebs
Gemischte Ergebnisse existieren für
- Prostatakrebs
- Hautkrebs
Wir werden uns die bisherigen Studien in diesen Bereichen weiter unten noch näher ansehen, zunächst soll aber betrachtet werden, unter welchen Bedingungen und durch welche Mechanismen Vitamin D Krebs beeinflussen kann.
Wie viel Vitamin D ist nötig zur Krebsprävention?
Eine deutliche Reduktion des Krebsrisikos ist in entsprechenden Studien erst ab Vitamin-D-Spiegeln von 40 ng/ml zu beobachten.[3] Zur Krebsprävention werden darum Vitamin-D-Spiegel von 40-60 ng/ml empfohlen.
Wie viel Vitamin D zum Erreichen dieser Werte nötig ist, hängt von vielen individuellen Faktoren, insbesondere der Sonnenexposition ab. Im Winter sind bei den meisten Menschen Dosierungen um die 2000-5000 IE nötig, um einen Blutwert von 40 ng/ml zu erreichen.
Zusätzlich zu Vitamin D sollte auch der Kofaktor Vitamin K2 eingenommen werden, welcher eng mit Vitamin D zusammenwirkt und ebenfalls für seine Krebs-vorbeugenden Eigenschaften erforscht wird.
Vorschläge für Vitamin-D-Präparate zur Krebs-Vorbeugung
Dosierung | Im Internet finden | |
Flexible Dosierung | 1000 IE Vitamin D3 + | |
Hochdosiert | 5000 IE Vitamin D3 + | Vitamin D3 + K2 MK7 + 5000 IE + 200µg K2 + hochdosiert + 100% all-trans |
Wie wirkt Vitamin D gegen Krebs?
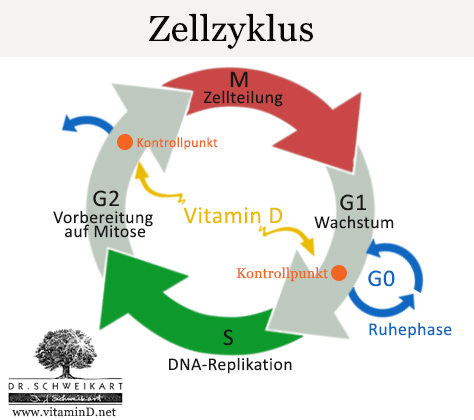
Das aktive Vitamin-D-Hormon Calcitriol steuert zahlreiche Zellprozesse, die direkt mit der Entstehung und dem Voranschreiten von Krebs in Verbindung stehen. Dazu gehören vor allem die Zellproliferation (Zellteilung und Zellwachstum) und die Steuerung des Zellzyklus und des Zelltodes.[4]
Auch bei den indirekten Ursachen für Krebs, wie chronische Entzündungen und DNA-Schäden spielt Vitamin D eine wichtige präventive Rolle.
Die bisherige Forschung hat folgende zentrale Mechanismen identifiziert, durch die Vitamin D bei Krebs-Erkrankungen wirksam wird:
Vitamin D Mechanismus | Auswirkung |
Indirekte Mechanismen | |
Vitamin D hemmt chronische Entzündungen | Entzündungen begünstigen die Entstehung von Krebs |
Vitamin D schützt vor DNA-Schäden | Genetische Schäden sind die zentrale Ursache für Krebs |
Vitamin D steuert die Autophagie | Autophagie ist ein Selbstreinigungsmechanismus der Zellen und spielte eine Rolle bei der Entstehung von Krebs |
Direkte Mechanismen | |
Vitamin D kontrolliert die Zellproliferation | Vitamin D stoppt die Entwicklung und das Wachstum maligner (bösartiger) Zellen. |
Vitamin D steuert den Zelltod | Vitamin D induziert den Zelltod in bösartigen Krebszellen. |
Vitamin D fördert die Zelldifferenzierung | Vitamin D kann Krebszellen zu weniger bösartigen Zelltypen differenzieren. |
Vitamin D steuert zahlreiche wichtige Zellenzyme und Glykoproteine (z.B. E-Cadherin, Matrix-Metalloproteasen) | Vitamin D unterbindet die Invasion in gesunde Zellen und die Metastasierung von Krebszellen |
Vitamin D steuert die Angiogenese (Bildung von Kapillarsystemen) | Vitamin D verhindert, das Tumore das Kapillarsystem aufbauen können, das sie zum Überleben brauchen. |
Indirekte Mechanismen: Entzündungen, DNA-Schäden und Autophagie
Krebs entsteht vermutlich durch Mutationen an einem der 5000 „Wächtergene“, welche die Gesundheit der Zelle und den Zellzyklus überwachen. Mutation und Schäden an diesen sogenannten Proto-Onkogenen und Tumorsuppressorgenen können zur Entstehung von Tumoren und Krebs führen, weil dadurch die Steuerung des Zellzyklus außer Kontrolle gerät.
Als krebserregend gelten daher alle Einflüsse, die das Erbgut verändern oder schädigen können. Neben Strahlung, Viren und Toxinen gelten auch chronische Entzündungen und oxidativer Stress in diesem Zusammenhang als zwei wichtige Ursachen der Entstehung von Krebs.
Chronische Entzündungen tragen auf verschiedene Weisen zur Entstehung von Krebs bei, zum Beispiel durch die Begünstigung genetischer Instabilität, die Überregulation der Zellteilung, einige epigenetische Prozesse und viele weitere Mechanismen. [5–9] Chronische Entzündungen rücken darum immer mehr in den Fokus der aktuellen Krebsforschung. Vitamin D spielt in diesem Zusammenhang eine sehr wichtige Rolle, denn es ist einer der zentralen Modulatoren des Immunsystems und verhindert die Entstehung chronischer Entzündungen.
Oxidativer Stress führt zu einer Zunahme von DNA-Schäden und Mutationen, welche die Entstehung von Krebs begünstigen.[10] Vitamin D spielt eine wichtige Rolle im Schutz vor oxidativen Zellschäden und in der Reparatur von DNA. [11, 12] Vitamin aktiviert wichtige Enzyme des antioxidativen Abwehrsystems. [11] Unter anderem ist es zum Beispiel für die Aktivierung des Enzyms G6PD zuständig, welches eine zentrale Rolle im Glutathion-Stoffwechsel spielt.
Insgesamt unterstützt Vitamin D alle drei wichtigen Schutzfunktionen des Immunsystems vor Krebs: Schutz vor Infektionen, Kontrolle von Entzündungen und Beseitigung von Krebszellen.[13–15]
Autophagie ist eine Art Selbstreinigungsmechanismus der Zellen, mit dem Zellen eigene Bestandteile abbauen und verwerten. Durch Autophagie werden Pathogene, aber auch beschädigte oder fehlerhafte Proteine und Zellbestandteile abgebaut, welche die Funktion der Zelle auf gefährliche Weise beeinträchtigen können. Autophagie ist darum essentiell zur Homöostase, Differenzierung und Gesunderhaltung der Zelle und spielt eine wichtige Rolle bei der Prävention diverser chronischer Krankheiten inklusive Krebs. Die Entdeckung der zentralen Bedeutung der Autophagie ist ein recht neuer und zentraler Durchbruch in unserem Gesundheitsverständnis und wurde im Jahr 2016 mit dem Nobelpreis für Medizin ausgezeichnet. Vitamin D steuert in diversen Zelltypen die Autophagie und trägt so zur Prävention von Krebs bei.[16]
Vitamin D und Krebs: Direkte Mechanismen
Steuerung der Zellproliferation
Eine Krebszelle wird zu einem Tumor, indem sie sich teilt und vermehrt. Bei Krebszellen sind dabei die Mechanismen außer Kraft gesetzt, welche in normalen Zellen die Zellteilung kontrollieren.
Vor jeder Teilung durchläuft eine Zelle eine Art Qualitätskontrolle: An sogenannten Kontrollpunkten wird die Gesundheit der Zelle untersucht, je nachdem wie diese ausfällt, treten vier verschiedene Szenarien ein: a) es wird das Signal zur weiteren Teilung gegeben, b) der Zellzyklus wird angehalten, c) die Zelle wird in eine Art „Ruhezustand“ versetzt (G0-Zustand) oder d) die Zelle wird zur Beseitigung durch Zelltod (Apoptose) markiert.
Vitamin D ist ein wichtiger Regulator des Zellzyklus und kann den Zellzyklus einer fehlerhaften Zelle anhalten, um sie daran zu hindern, sich weiter zu teilen.[17] Vitamin D stoppt auf diese Weise in Laborversuchen die Zellteilung und das Wachstum maligner (bösartiger) Tumorzellen verschiedener Krebsarten.[18–28]
Allein aus diesem Grund wird Vitamin D heute in aktuellen Studien dringend als begleitende Maßnahme in der Krebsbehandlung empfohlen.[29]
Steuerung des Zelltodes (Apoptose)
Vitamin D ist außerdem in der Lage, Krebszellen zur Selbstzerstörung anzuregen, was zum einen die Entstehung von Krebstumoren verhindern kann, andererseits aber auch helfen könnte, bestehenden Krebs zu bekämpfen.
Dieser programmierte Zelltod wird als Apoptose bezeichnet und oft als eine Art Selbstmord-Mechanismus der Zelle beschrieben. Das Signal für die Apoptose kann dabei von der Zelle selbst kommen oder von außen angeregt werden.
Vitamin D induziert auf bisher noch nicht ganz geklärte Weise den Zelltod in verschiedenen Krebszellen und trägt so dazu bei, Tumore zu bekämpfen und an der Ausbreitung zu hindern.[30–34]
Zelldifferenzierung
Als Differenzierung von Zellen wird die spezifische Ausformung von Zellen in bestimmten Geweben bezeichnet: Alle Zellen tragen das gleiche, vollständige Erbgut und werden über epigenetische Mechanismen dazu veranlasst, sich auf eine bestimmte Art und Weise auszuformen. So unterscheiden sich Leberzellen dann in Aussehen und Funktion deutlich von Nervenzellen, obwohl beide die grundsätzlich gleiche DNA-Information in sich tragen.
Bösartige Krebs-Zellen zeichnen sich dadurch aus, dass sie undifferenziert sind. Gelingt es, in Krebszellen die Differenzierung anzuregen, kann dies das Wachstum und die Aggressivität des Tumors deutlich mindern. Einige neue Therapieverfahren zielen auf diesen Mechanismus ab.[35]
Auch hier trägt Vitamin D berechtigte Hoffnungen, denn das Vitamin spielt eine Rolle in verschiedenen Signalwegen, welche die Differenzierung von Zellen regeln. [36–40]
Steuerung der Angiogenese
Krebstumore wachsen recht schnell und haben einen hohen Bedarf an Nährstoffen. Um diesen zu befriedigen, senden Krebstumore spezielle Botenstoffe aus, welche die Neubildung von Blutgefäßen anregen. Man könnte sagen, dass Krebstumore sich auf diese Weise eigenes Versorgungssystem aus Blutgefäßen aufbauen – ein Prozess, der als Angiogenese bezeichnet wird.
Die Hemmung der Angiogenese ist ein neuer Therapieansatz in der Krebstherapie, welcher den Krebs sozusagen aushungern soll. Vitamin D könnte auch hier eine wichtige Rolle einnehmen, da zahlreiche Studien zeigen konnten, dass Vitamin D die Angiogenese von Krebstumoren unterbindet. [41–44]
Metastasierung
Einer der gefährlichsten Aspekte einer Krebserkrankung ist die Metastasierung, also die Streuung von Krebszellen in andere Gewebe.
Metastasen entstehen, indem sich die Krebszellen vom ursprünglichen Tumor ablösen, und dann über das Blut- oder Lymphsystem in andere Körperteile wandern, um sich dort wieder anzusiedeln und zu vermehren. Dies kann nur bei bösartigen, invasiven Formen von Krebs auftreten. Diese Tumore wachsen tief in angrenzendes Gewebe und Blut und Lymphgefäße hinein. Lösen sich nun Zellen vom Tumor ab, können diese in entfernte Gewebe transportiert werden und dort einen neuen Tumor entwickeln.
Dass sich Krebszellen von einem Tumor ablösen, hängt mit der Konzentration von speziellen „Klebemolekülen“, den sogenannten Cadherinen, auf der Oberfläche der Krebszellen zusammen. Vitamin D reguliert verschiedene solche „Zellkleber“ wie E-Cadherin, Fibronektin nach oben und unterbindet so die Metastasierung von Krebs in diversen Labormodellen.[42, 45, 46]
Auch in in-vivo Tierversuchen an lebenden Tieren zeigt sich eine starke anti-metastatische Wirkung von Vitamin D. Vitamin D mindert die Metastasierung und Streuung von Hautkrebs[47], Lungenkrebs[48], Brustkrebs[49] und Prostatakrebs[50]. Ein Vitamin-D-Mangel auf der anderen Seite führt in solchen Versuchen zu einer deutlich erhöhten Bildung von Metastasen.[51]
Insgesamt zeigen sich auch hier überzeugende Beweise für eine zentrale Rolle in der Streuung von Krebs und der Bildung von Metastasen.
Vitamin D und Krebs-Studien
Die Labor- und Tierversuche sprechen also einhellig und deutlich für eine wichtige Rolle von Vitamin D bei Krebs. Leider sind die bisherigen Studien an Menschen weniger eindeutig.
Grundsätzlich gibt es zwei Arten von Studien, die unterschiedliche Fragestellungen bearbeiten.
Epidemiologische Studien/Korrelationsstudien
Gibt es einen Zusammenhang von Vitamin-D-Spiegeln und Krebs?Interventionsstudien
Lässt sich Krebs mit Vitamin D verhindern oder behandeln?
Epidemiologische Studien
Krebs-Prävention mit Vitamin D
Die meisten epidemiologischen Studien zeigen, dass niedrige Vitamin-D-Spiegel mit einem deutlich erhöhten Risiko für Krebs einhergehen, wie mehrere Metastudien belegen.[52, 53] Vitamin-D-Spiegel von 40 ng/ml reduzierten das Risiko einer Krebserkrankung dabei um bis zu 65 Prozent.[3]
Einzig für Prostatakrebs sind die Ergebnisse extrem widersprüchlich: Während mehrere Studien mit steigenden Vitamin-D-Spiegel ein höheres Risiko beobachten [54, 55], berichten andere Studien von deutlich besseren Überlebenschancen durch höhere Vitamin-D-Spiegel bei dieser Krebsart.[56] Es gibt verschiedene Theorien, warum Prostatakrebs sich so anders verhält als die anderen Krebsarten. Eine der bislang plausibelsten ist, dass die Prostata neben der Niere eines der wenigen Gewebe ist, die über Megalin-Rezeptoren verfügen, einem aktiven Aufnahmemechanismus für Vitamin D. Ein Überangebot von Vitamin D könnte hier im Nebeneffekt zu einer erhöhten Aufnahme auch des Hormons Testosteron führen, dass eng mit Prostatakrebs in Verbindung steht.[57]
Besserer Krankheitsverlauf durch Vitamin D
Höhere Vitamin-D-Spiegel korrelieren in zahlreichen Studien an Krebs-Patienten auch mit einem deutlich besseren Krankheitsverlauf und einer deutlich höheren Lebenserwartung, wie entsprechende Metaanalysen bestätigen.[58] Besonders eindeutige Ergebnisse zeigten sich hier für Darmkrebs und Brustkrebs.[59] Das Risiko von Krebspatienten an ihrer Erkrankung zu versterben, reduziert sich laut einer Metastudie um beeindruckende 35 Prozent (Darmkrebs) und 43 Prozent (Brustkrebs). Diese Ergebnisse bestätigten sich auch in anderen Metastudien wiederholt.[60] Auch hier zeigte sich bis zu Blutspiegeln von 40 ng/ml ausnahmslos eine deutliche Abnahme der Sterblichkeit.
Bei einigen anderen Krebs-Erkrankungen existieren bisher zu wenige oder widersprüchliche Ergebnisse, um gültige Schlüsse ziehen zu können.[61]
Interventionsstudien
Interventionsstudien untersuchen, ob eine Verabreichung von Vitamin D die Häufigkeit (Präventionsstudie) oder den Krankheitsverlauf (klinische Studie) einer Krebserkrankung beeinflusst.
Präventionsstudien
Wie oben bereits angedeutet, erbrachten Präventionsstudien bisher keine eindeutigen Ergebnisse. [62, 63] Dies ist aber vermutlich vor allem mangelhaften Studiendesigns zuzuschreiben. Untersucht wurde vor allem, ob eine bestimmte Menge Vitamin D das Auftreten von Krebs beeinflussen kann. Nach den Erkenntnissen aus den epidemiologischen Studien ist dies jedoch die falsche Fragestellung. Die richtige Frage ist vielmehr, ob eine Korrektur von mangelhaften Vitamin-D-Spiegeln auf ein ausreichendes Niveau von mindestens 40 ng/ml zur Prävention von Krebs taugt.
Diese Frage wurde bisher aber nicht untersucht. Bei vielen der bisher gemachten Studien waren die Dosierungen mit teilweise nur 400 IE [64] zu gering, um Aufschlüsse in dieser Frage zu geben. Auch etwas höher dosierte Studien erzielten teilweise gerademal einen mittleren Anstieg der Vitamin-D-Spiegel um 7 ng/ml [65], was ebenfalls keine ausreichenden Schlüsse zulässt.
Einige Studien kamen trotzdem zu positiven Ergebnissen: Eine Studie mit 1100 IE Vitamin D plus Calcium reduzierte das Krebsrisiko bei postmenopausalen Frauen um fast 70 Prozent.[66] Das Ergebnis überrascht aufgrund der geringen Dosierung, jedoch hatten die Studienteilnehmer hier deutliche höhere Ausgangsspiegel als in anderen Studien und konnten ihren Vitamin-D-Spiegel durch die 1000 IE auf immerhin 38 ng/ml anheben, was die guten Ergebnisse erklärt.
All dies lässt hoffen, dass Studien mit wirklich adäquaten Dosierungen noch bessere Ergebnisse liefern können. Derzeit sind einige solcher Studien unterwegs – bis zu deren Auswertung werden allerdings noch einige Jahre vergehen.
Klinische Studien
Eine Interventionsstudie mit 4000 IE Vitamin D an Männern mit niedriggradigem Prostatakrebs im Frühstadium zeigte einen deutlichen Rückgang der von Krebs befallenen Bereiche.[67]
Auch in den bereits genannten Präventionsstudien zeigte sich überraschenderweise bereits ab Dosierungen von nur 800 IE ein Rückgang der Sterblichkeitsraten von deutlichen 12%.[63] Dieser Effekt zeigte sich durchgehend in fast allen Studien und bestätigt die Ergebnisse ähnlicher Metaanalysen.[68]
Eine Erklärung für die widersprüchlichen Ergebnisse der Präventionsstudien – Krebs konnte nicht verhindert werden, die Heilungsaussichten sind aber besser – liefert möglicherweise der Unterschied von Mangel und Unterversorgung: Die Probanden der genannten Studien konnten durch die geringen Dosierungen zwar aus dem Bereich eines schweren Mangels in den Bereich einer Unterversorgung angehoben werden, was die Überlebenschancen deutlich verbesserte, seine volle präventive Wirkung scheint Vitamin D aber erst bei wirklich ausreichender Versorgung und Blutspiegeln um die 40 ng/ml zu entfalten.
Neue Einsichten: Einfluss des Vitamin-D-Stoffwechsels
Die heterogenen Ergebnisse einiger Studien lassen sich neben zu geringer Dosierung und falschen Fragestellungen vermutlich auch auf bisher nicht beachtete Zusammenhänge zurückführen. Immer deutlicher wird in der Forschung nämlich auch, welche große Rolle der individuelle Vitamin-D-Stoffwechsel bei Krebs spielt. Individuelle genetische Faktoren, aber auch krankheitsbedingte Regulationsstörungen können hier die Wirksamkeit des Vitamin D stark beeinflussen. Dieser Bereich ist bisher nur unzureichend verstanden, sollte hier aber trotzdem unbedingt Erwähnung finden, da er einige der interessantesten Aspekte der aktuellen Forschung beinhaltet.
Der Vitamin-D-Stoffwechsel ist eine sehr individuelle Angelegenheit, da die Genetik verschiedene Aspekte in der Vitamin-D-Regulierung stark beeinflusst. So sind die Enzyme, welche für die Umwandlung des Vitamin D in seine verschiedenen Formen zuständig sind, genetisch unterschiedlich stark ausgeprägt. Auch der Vitamin-D-Rezeptor selbst kommt in zahlreichen verschiedenen genetischen Varianten vor – sogenannten Polymorphismen – die seine Funktion stark beeinflussen. Zuletzt spielt auch das Vitamin-D-Transportmolekül DBP eine spannende Rolle, dass in unterschiedlichen Konzentrationen und Phänotypen vorkommt.
Vitamin-D-Enzyme und Krebs
Vitamin D muss vom Körper in zwei Schritten umgewandelt werden, um von Vitamin D über die Transportform 25-OH-D zum aktiven Vitamin-D-Hormon Calcitriol umgewandelt zu werden. Hat es seine Aufgabe erfüllt wird das aktive Hormon wieder abgebaut. Für all diese Schritte sind spezielle Enzyme notwendig.
Wie wir heute wissen, gibt es zwei getrennte Wege, wie aus Vitamin D das aktive Vitamin-D-Hormon gebildet werden kann.
Endokriner Weg: Hier wird das aufgenommenen Vitamin D in der Leber zu 25-OH-D umgewandelt, über das Blut zur Niere transportiert und dort zum aktiven Vitamin-D-Hormon Calcitriol umgewandelt, was ebenfalls ins Blut gelangt. Dieser Weg wird durch zentral gesteuerte hormonelle Regelkreise streng reguliert und dient der Regulierung der Calciumaufnahme. Der zweite Schritt dieses Weges bestimmt auch den Blutspiegel an 25-OH-D, der in Studien untersucht wird.
Autokriner/Parakriner Weg: Für die Krebs-Wirkungen des Vitamin D ist aber ein ganz anderer, dezentraler Wirkweg ausschlaggebend, der dieser Regulation nicht unterliegt. Die Umwandlung des Vitamin D in seine aktiven Formen, aber auch die Deaktivierung des Vitamin-D-Hormons, finden hier vor Ort direkt in den entsprechenden Geweben (oder Tumoren) statt und werden von den Zellen selbst reguliert. Die Zellen können dabei nur unhydroxyliertes Vitamin D oder freies, ungebundenes 25-OH-D aufnehmen.
Eine erste Erkenntnis aus diesem Zusammenhang ist, dass der Blutspiegel der Transportform 25-OH-D gar nicht die relevante Größe ist. Zwar gibt er guten Aufschluss über die allgemeine Versorgung mit Vitamin D, aber weniger über die Konzentrationen der verschiedenen Formen von Vitamin D in den einzelnen Geweben, da die Gewebe diese Konzentrationen selbst steuern. Auch kann der Großteil des 25-OH-D im Blut vermutlich keine Wirkung in den Zellen entfalten, weil es an DBP gebunden ist.
Die Fähigkeit der Zellen, selbst aktives Vitamin D herzustellen, hängt einerseits von ausreichender Versorgung mit den Ausgangsstoffen ab und andererseits von der Aktivität der entsprechenden Enzyme, die individuell unterschiedlich ausgeprägt sein kann. Krebs verändert außerdem die Aktivität dieser Enzyme erheblich.
Interessant ist hier zum Beispiel, dass Studien einen deutlichen Zusammenhang zwischen der Aktivität des Enyzms, welches Vitamin D zur Speicherform 25-OH-D umwandelt und der Sterblichkeitsrate bei Krebs feststellen konnten.[69] Dies legt nahe, dass die Krebswirkungen des Vitamin D erheblich von der zellulären Regulierung der aktiven Form abhängig sind und vor allem unhydroxyliertes Vitamin D – nicht 25-OH-D – benötigen. Unhydroxyliertes Vitamin D wird aber binnen 24 Stunden ausgeschieden und findet sich nur in ausreichenden Mengen im Blut, wenn es täglich zugeführt wird. [70] Dies würde erklären, warum einerseits Wochen- und Monatsdosen bei Krebs scheinbar weniger Wirkung entfalten und warum andererseits der 25-OH-D-Spiegel nicht immer klar mit dem Krebsrisiko korreliert.
Die generelle genetische Ausprägung der relevanten Enzyme könnte die Wirksamkeit von Vitamin D bei Krebs also stark beeinflussen. Identische Blutspiegel würden dann nicht immer den gleichen biologischen Effekt haben. Dieser Verdachte erhärtet sich durch entsprechende Korrelationsstudien, welche einen deutlichen Zusammenhang zwischen genetischen Variationen der relevanten Enzyme und Krebs zeigen.[71]
Es konnte auch gezeigt werden, dass die zelluläre Kommunikation in Tumoren stark verändert ist. Beinahe wie zu ihrem Selbstschutz scheinen Tumore genau das Enzym nach oben regulieren, welches für die Zerstörung des aktiven Vitamin D zuständig ist.[72, 73] Durch diesen verstärkten Abbau kann das Vitamin D keine ausreichende Wirkung mehr entfalten. Die Wirkung konnte in Versuchen jedoch wieder hergestellt werden, wenn das Vitamin D zusammen mit einem Enzym-Hemmer verabreicht wurde, welcher das entsprechende Enzym hemmte.[74, 75] Aktuell wird erforscht, wie diese Kombination sicher in der Therapie eingesetzt werden kann.[76]
Vitamin D Rezeptor
Auch der Vitamin-D-Rezeptor (VDR) spielt eine große Rolle. Studien konnten hier zeigen, dass vor allem auch die Menge der Vitamin-D-Rezeptoren in einem Gewebe ausschlaggebend für den Verlauf einer Krebs-Erkrankung ist.[77] In vielen Krebserkrankungen nimmt die Anzahl der VDR mit zunehmendem Verlauf jedoch drastisch ab, weil der Tumor die Vitamin-D-Rezeptoren abbaut.[78, 79] Verantwortlich dafür sind bestimmte Botenstoffe, welche die Expression der VDR reduzieren, insbesondere zwei als SNAIL 1 und 2 bezeichnete Stoffe. Durch den Abbau der VDR werden die Tumore resistent gegen Vitamin D. Doch auch hier wurden neue Therapieansätze entwickelt, welche durch eine Unterdrückung von SNAIL die Wirksamkeit des Vitamin-D wieder herstellen.[80]
Auch verschiedene Mutationen am VDR werden mit Krebserkrankungen in Verbindung gebracht. Hier ist die Datenlage jedoch recht unklar, da die Studien zu sehr unterschiedlichen Ergebnissen kommen, wenngleich sich eine Korrelation zwischen bestimmten Mutationen und Krebs abzeichnet.[81–84]
DBP
Zuletzt steht auch die Konzentration des Transportmoleküls DBP in Zusammenhang mit Krebs und zwar in recht komplexer Weise. Zum einen bestimmt das Verhältnis von DBP zu 25-OH-D wie viel freies 25-OH-D zirkuliert. Derzeit wird erforscht, ob dieses Verhältnis eine Rolle spielt, denn bei einigen Krebsarten könnte, wie oben angedeutet, dieses freie 25-OH-D und nicht der Gesamtspiegel die ausschlaggebende Größe sein.[85, 86] Dies führt zu einiger Komplexität da sich so diverse mögliche Kombinationen der beiden Größen (Menge der Transportmoleküle und Menge des Vitamin D) ergeben. Tatsächlich konnten diverse Studien statische Zusammenhänge finden. Ob diese kausal sind, und was sie bedeuten, ist jedoch noch nicht klar.[87]
Interessanterweise ist DBP aber nicht nur das Transportmolekül für Vitamin D, sondern auch die direkte Vorstufe zum Makrophagen-aktierenden Faktor (GC-MAF). GcMAF ist ein Immunbotenstoff, der, wie der Name es nahe legt, für die Funktion der Makrophagen wichtig ist und der seit einigen Jahren mit äußerst beeindruckenden Ergebnissen als Alternative zur Chemotherapie eingesetzt wird.[88–91] GcMAF aktiviert die Makrophagen, die dadurch mittels spezieller Rezeptoren in die Lage versetzt werden, Krebszellen zu erkennen und auszuschalten. Auf diese Weise können Tumore vom Immunsystem selbst erkannt und zurückgebildet werden. GcMAF wird derzeit erfolgreich bei verschiedenen Art von Krebs wie Prostata-, Brust-, Lungenkrebs eingesetzt.
Und als ob dies alles nicht schon kompliziert genug wäre, existiert DBP auch noch in sechs verschiedenen genetischen Phänotypen, die jeweils unterschiedlich gut Vitamin D binden und unterschiedlich gut zu GcMAF weiterverarbeitet werden.[93] Hier tut sich also nochmal ein ganzes Forschungsfeld auf, das vermutlich gänzlich neue Aspekte zutage fördern könnte.
Die Zusammenhänge zwischen DBP und Krebs sind also derzeit alles andere als klar. Niedrige DBP-Level scheinen generell das Risiko für Krebs zu erhöhen.[92] Einige Studien zu Prostatakrebs kommen jedoch auch hier zu teilweise gegenteiligen Ergebnissen. Generell scheinen niedrige Vitamin D zu DBP Verhältnisse sich negativ auszuwirken – warum das so ist, weiß man bisher jedoch nicht.
Fazit Vitamin D und Krebs
Der Zusammenhang von Vitamin D und Krebs ist komplex. Alles deutet jedoch aktuell darauf hin, dass Vitamin D in der Tat eine große Rolle in der Prävention und Behandlung von Krebs spielt. Die Zell- und Tierversuche sind durchweg positiv und die Unzulänglichkeiten der bisherigen Interventionsstudien recht offensichtlich. Das immer bessere Verständnis des Vitamin-D-Stoffwechsels gibt zudem gute Anhaltspunkte, die Unterschiede in verschiedenen Studienergebnissen zu erklären, wenngleich noch immer großer Forschungsbedarf besteht.
Vor dem Hintergrund der starken Indizien kann eine Einnahme von Vitamin D zur Prävention und ergänzenden Behandlung von Krebs empfohlen werden. Dabei sind nach aktuellem Wissensstand Blutspiegel von mindestens 40ng/ml nötig, um eine optimale präventive Wirkung zu erreichen. Dies entspricht Winterdosen von 2000 bis 5000 IE Vitamin D.
Quellen
1. Grant WB (2012) Ecological studies of the UVB-vitamin D-cancer hypothesis. Anticancer Res 32:223–236 PMID: 22213311
2. Bikle DD (2014) Vitamin D and Cancer The Promise not yet Fulfilled. Endocrine 46:29–38 PMCID: PMC3976762
3. McDonnell SL, Baggerly C, French CB, Baggerly LL, Garland CF, Gorham ED, Lappe JM, Heaney RP (2016) Serum 25-Hydroxyvitamin D Concentrations ≥40 ng/ml Are Associated with >65% Lower Cancer Risk: Pooled Analysis of Randomized Trial and Prospective Cohort Study. PLoS ONE. doi: 10.1371/journal.pone.0152441 PMCID: PMC4822815
4. Fleet JC, DeSmet M, Johnson R, Li Y (2012) Vitamin D and Cancer: A review of molecular mechanisms. Biochem J 441:61–76 PMCID: PMC4572477
5. Mantovani A (2005) Cancer: inflammation by remote control. Nature 435:752–753 PMID: 15944689
6. Diakos CI, Charles KA, McMillan DC, Clarke SJ (2014) Cancer-related inflammation and treatment effectiveness. Lancet Oncol 15:e493-503 PMID: 25281468
7. Atsumi T, Singh R, Sabharwal L, et al (2014) Inflammation Amplifier, a New Paradigm in Cancer Biology. Cancer Res 74:8–14 DOI: 10.1158/0008-5472.CAN-13-2322
8. Coussens LM, Werb Z (2002) Inflammation and cancer. Nature 420:860–867 PMCID: PMC2803035
9. van Harten-Gerritsen AS, Balvers MGJ, Witkamp RF, Kampman E, van Duijnhoven FJB (2015) Vitamin D, Inflammation, and Colorectal Cancer Progression: A Review of Mechanistic Studies and Future Directions for Epidemiological Studies. Cancer Epidemiol Biomarkers Prev 24:1820–1828 DOI: 10.1158/1055-9965.EPI-15-0601
10. Reuter S, Gupta SC, Chaturvedi MM, Aggarwal BB (2010) Oxidative stress, inflammation, and cancer: How are they linked? Free Radic Biol Med 49:1603–1616 PMCID: PMC2990475
11. Banakar MC, Paramasivan SK, Chattopadhyay MB, Datta S, Chakraborty P, Chatterjee M, Kannan K, Thygarajan E (2004) 1α, 25-dihydroxyvitamin D3 prevents DNA damage and restores antioxidant enzymes in rat hepatocarcinogenesis induced by diethylnitrosamine and promoted by phenobarbital. World J Gastroenterol 10:1268–1275 PMCID: PMC4622764
12. Bao B-Y, Ting H-J, Hsu J-W, Lee Y-F (2008) Protective role of 1 alpha, 25-dihydroxyvitamin D3 against oxidative stress in nonmalignant human prostate epithelial cells. Int J Cancer 122:2699–2706 PMID: 18348143
13. Schreiber RD, Old LJ, Smyth MJ (2011) Cancer immunoediting: integrating immunity’s roles in cancer suppression and promotion. Science 331:1565–1570 PMID: 21436444
14. Chun RF, Liu PT, Modlin RL, Adams JS, Hewison M (2014) Impact of vitamin D on immune function: lessons learned from genome-wide analysis. Front Physiol. doi: 10.3389/fphys.2014.00151 PMCID: PMC4000998
15. Prietl B, Treiber G, Pieber T, Amrein K (2013) Vitamin D and Immune Function. Nutrients 5:2502–2521 DOI: 10.3390/nu5072502
16. Høyer-Hansen M, Nordbrandt SPS, Jäättelä M (2010) Autophagy as a basis for the health-promoting effects of vitamin D. Trends Mol Med 16:295–302 PMID: 20488750
17. Banerjee P, Chatterjee M (2003) Antiproliferative role of vitamin D and its analogs–a brief overview. Mol Cell Biochem 253:247–254 PMID: 14619976
18. Colston K, Colston MJ, Feldman D (1981) 1,25-dihydroxyvitamin D3 and malignant melanoma: the presence of receptors and inhibition of cell growth in culture. Endocrinology 108:1083–1086 PMID: 6257495
19. Hager G, Formanek M, Gedlicka C, Thurnher D, Knerer B, Kornfehl J (2001) 1,25(OH)2 vitamin D3 induces elevated expression of the cell cycle-regulating genes P21 and P27 in squamous carcinoma cell lines of the head and neck. Acta Otolaryngol (Stockh) 121:103–109 PMID: 11270487
20. Wu W, Zhang X, Zanello LP (2007) 1α,25-dihydroxyvitamin D3 antiproliferative actions involve vitamin D receptor-mediated activation of MAPK pathways and AP-1/p21waf1 upregulation in human osteosarcoma. Cancer Lett 254:75–86 PMCID: PMC2760385
21. Colston KW, Perks CM, Xie SP, Holly JM (1998) Growth inhibition of both MCF-7 and Hs578T human breast cancer cell lines by vitamin D analogues is associated with increased expression of insulin-like growth factor binding protein-3. J Mol Endocrinol 20:157–162 PMID: 9513092
22. Jensen SS, Madsen MW, Lukas J, Binderup L, Bartek J (2001) Inhibitory effects of 1alpha,25-dihydroxyvitamin D(3) on the G(1)-S phase-controlling machinery. Mol Endocrinol Baltim Md 15:1370–1380 PMID: 11463860
23. Flores O, Wang Z, Knudsen KE, Burnstein KL (2010) Nuclear Targeting of Cyclin-Dependent Kinase 2 Reveals Essential Roles of Cyclin-Dependent Kinase 2 Localization and Cyclin E in Vitamin D-Mediated Growth Inhibition. Endocrinology 151:896–908 PMCID: PMC2840684
24. Li P, Li C, Zhao X, Zhang X, Nicosia SV, Bai W (2004) p27Kip1 Stabilization and G1 Arrest by 1,25-Dihydroxyvitamin D3 in Ovarian Cancer Cells Mediated through Down-regulation of Cyclin E/Cyclin-dependent Kinase 2 and Skp1-Cullin-F-box Protein/Skp2 Ubiquitin Ligase. J Biol Chem 279:25260–25267 DOI: 10.1074/jbc.M311052200
25. Lointier P, Wargovich MJ, Saez S, Levin B, Wildrick DM, Boman BM (1987) The role of vitamin D3 in the proliferation of a human colon cancer cell line in vitro. Anticancer Res 7:817–821 PMID: 2823686
26. Swami S, Raghavachari N, Muller UR, Bao YP, Feldman D (2003) Vitamin D growth inhibition of breast cancer cells: gene expression patterns assessed by cDNA microarray. Breast Cancer Res Treat 80:49–62 PMID: 12889598
27. Getzenberg RH, Light BW, Lapco PE, et al (1997) Vitamin D inhibition of prostate adenocarcinoma growth and metastasis in the Dunning rat prostate model system. Urology 50:999–1006 PMID: 9426741
28. Yang ES, Burnstein KL (2003) Vitamin D Inhibits G1 to S Progression in LNCaP Prostate Cancer Cells through p27Kip1 Stabilization and Cdk2 Mislocalization to the Cytoplasm. J Biol Chem 278:46862–46868 DOI: 10.1074/jbc.M306340200
29. Spath L, Ulivieri A, Lavra L, et al (2017) Antiproliferative Effects of 1α-OH-vitD3 in Malignant Melanoma: Potential Therapeutic implications. Sci Rep. doi: 10.1038/srep40370 PMCID: PMC5225467
30. Guzey M, Kitada S, Reed JC (2002) Apoptosis induction by 1alpha,25-dihydroxyvitamin D3 in prostate cancer. Mol Cancer Ther 1:667–677 PMID: 12479363
31. Mathiasen IS, Lademann U, Jäättelä M (1999) Apoptosis induced by vitamin D compounds in breast cancer cells is inhibited by Bcl-2 but does not involve known caspases or p53. Cancer Res 59:4848–4856 PMID: 10519395
32. Díaz GD, Paraskeva C, Thomas MG, Binderup L, Hague A (2000) Apoptosis is induced by the active metabolite of vitamin D3 and its analogue EB1089 in colorectal adenoma and carcinoma cells: possible implications for prevention and therapy. Cancer Res 60:2304–2312 PMID: 10786699
33. Kovalenko PL, Zhang Z, Yu J-G, Li Y, Clinton SK, Fleet JC (2011) Dietary vitamin d and vitamin d receptor level modulate epithelial cell proliferation and apoptosis in the prostate. Cancer Prev Res Phila Pa 4:1617–1625 PMCID: PMC3188351
34. Narvaez CJ, Welsh J (2001) Role of Mitochondria and Caspases in Vitamin D-mediated Apoptosis of MCF-7 Breast Cancer Cells. J Biol Chem 276:9101–9107 DOI: 10.1074/jbc.M006876200
35. Leszczyniecka M, Roberts T, Dent P, Grant S, Fisher PB (2001) Differentiation therapy of human cancer: basic science and clinical applications. Pharmacol Ther 90:105–156 PMID: 11578655
36. Wang X, Studzinski GP (2001) Activation of extracellular signal-regulated kinases (ERKs) defines the first phase of 1,25-dihydroxyvitamin D3-induced differentiation of HL60 cells. J Cell Biochem 80:471–482 PMID: 11169731
37. Aguilera O, Peña C, García JM, et al (2007) The Wnt antagonist DICKKOPF-1 gene is induced by 1alpha,25-dihydroxyvitamin D3 associated to the differentiation of human colon cancer cells. Carcinogenesis 28:1877–1884 PMID: 17449905
38. Pálmer HG, González-Sancho JM, Espada J, et al (2001) Vitamin D3 promotes the differentiation of colon carcinoma cells by the induction of E-cadherin and the inhibition of β-catenin signaling. J Cell Biol 154:369–388 PMCID: PMC2150773
39. Gröschel C, Aggarwal A, Tennakoon S, Höbaus J, Prinz-Wohlgenannt M, Marian B, Heffeter P, Berger W, Kállay E (2016) Effect of 1,25-dihydroxyvitamin D3 on the Wnt pathway in non-malignant colonic cells. J Steroid Biochem Mol Biol 155:224–230 PMID: 25777538
40. Larriba M, González-Sancho J, Barbáchano A, Niell N, Ferrer-Mayorga G, Muñoz A (2013) Vitamin D Is a Multilevel Repressor of Wnt/b-Catenin Signaling in Cancer Cells. Cancers 5:1242–1260 DOI: 10.3390/cancers5041242
41. Mantell DJ, Owens PE, Bundred NJ, Mawer EB, Canfield AE (2000) 1 ,25-Dihydroxyvitamin D3 Inhibits Angiogenesis In Vitro and In Vivo. Circ Res 87:214–220 DOI: 10.1161/01.RES.87.3.214
42. Nakagawa K, Sasaki Y, Kato S, Kubodera N, Okano T (2005) 22-Oxa-1alpha,25-dihydroxyvitamin D3 inhibits metastasis and angiogenesis in lung cancer. Carcinogenesis 26:1044–1054 PMID: 15718253
43. Chung I, Han G, Seshadri M, Gillard BM, Yu W, Foster BA, Trump DL, Johnson CS (2009) Role of VDR in anti-proliferative effects of calcitriol in tumor-derived endothelial cells and tumor angiogenesis in vivo. Cancer Res 69:967–975 PMCID: PMC2752059
44. Bao B-Y, Yao J, Lee Y-F (2006) 1alpha, 25-dihydroxyvitamin D3 suppresses interleukin-8-mediated prostate cancer cell angiogenesis. Carcinogenesis 27:1883–1893 PMID: 16624828
45. Liu W, Asa SL, Ezzat S (2005) 1α,25-Dihydroxyvitamin D3 Targets PTEN-Dependent Fibronectin Expression to Restore Thyroid Cancer Cell Adhesiveness. Mol Endocrinol 19:2349–2357 DOI: 10.1210/me.2005-0117
46. Ma Y, Yu W-D, Su B, Seshadri M, Luo W, Trump DL, Johnson CS (2013) Regulation of motility, invasion, and metastatic potential of squamous cell carcinoma by 1α,25-dihydroxycholecalciferol: 1α,25D 3 Regulates Motility and Invasion. Cancer 119:563–574 DOI: 10.1002/cncr.27531
47. Yudoh K, Matsuno H, Kimura T (1999) 1alpha,25-dihydroxyvitamin D3 inhibits in vitro invasiveness through the extracellular matrix and in vivo pulmonary metastasis of B16 mouse melanoma. J Lab Clin Med 133:120–128 PMID: 9989763
48. Nakagawa K, Kawaura A, Kato S, Takeda E, Okano T (2005) 1 alpha,25-Dihydroxyvitamin D(3) is a preventive factor in the metastasis of lung cancer. Carcinogenesis 26:429–440 PMID: 15539405
49. El Abdaimi K, Dion N, Papavasiliou V, Cardinal PE, Binderup L, Goltzman D, Ste-Marie LG, Kremer R (2000) The vitamin D analogue EB 1089 prevents skeletal metastasis and prolongs survival time in nude mice transplanted with human breast cancer cells. Cancer Res 60:4412–4418 PMID: 10969786
50. Lokeshwar BL, Schwartz GG, Selzer MG, Burnstein KL, Zhuang SH, Block NL, Binderup L (1999) Inhibition of prostate cancer metastasis in vivo: a comparison of 1,23-dihydroxyvitamin D (calcitriol) and EB1089. Cancer Epidemiol Biomark Prev Publ Am Assoc Cancer Res Cosponsored Am Soc Prev Oncol 8:241–248 PMID: 10090302
51. Zheng Y, Zhou H, Ooi LL, Snir AD, Dunstan CR, Seibel MJ (2011) Vitamin D deficiency promotes prostate cancer growth in bone. The Prostate 71:1012–1021 PMID: 21541977
52. Yin L, Ordóñez-Mena JM, Chen T, Schöttker B, Arndt V, Brenner H (2013) Circulating 25-hydroxyvitamin D serum concentration and total cancer incidence and mortality: a systematic review and meta-analysis. Prev Med 57:753–764 PMID: 24036014
53. Ordóñez Mena JM, Brenner H (2014) Vitamin D and cancer: an overview on epidemiological studies. Adv Exp Med Biol 810:17–32 PMID: 25207358
54. Kristal AR, Till C, Song X, et al (2014) Plasma vitamin D and prostate cancer risk: Results from the Selenium and Vitamin E Cancer Prevention Trial. Cancer Epidemiol Biomark Prev Publ Am Assoc Cancer Res Cosponsored Am Soc Prev Oncol 23:1494–1504 PMCID: PMC4119495
55. Xu Y, Shao X, Yao Y, Xu L, Chang L, Jiang Z, Lin Z (2014) Positive association between circulating 25-hydroxyvitamin D levels and prostate cancer risk: new findings from an updated meta-analysis. J Cancer Res Clin Oncol 140:1465–1477 PMID: 24838848
56. Mondul AM, Weinstein SJ, Moy KA, Männistö S, Albanes D (2016) Circulating 25-hydroxyvitamin D and prostate cancer survival. Cancer Epidemiol Biomark Prev Publ Am Assoc Cancer Res Cosponsored Am Soc Prev Oncol 25:665–669 PMCID: PMC4873366
57. Weinstein SJ, Mondul AM, Kopp W, Rager H, Virtamo J, Albanes D (2013) Circulating 25-Hydroxyvitamin D, Vitamin D Binding Protein, and Risk of Prostate Cancer. Int J Cancer J Int Cancer 132:2940–2947 PMCID: PMC3594427
58. Li M, Chen P, Li J, Chu R, Xie D, Wang H (2014) Review: the impacts of circulating 25-hydroxyvitamin D levels on cancer patient outcomes: a systematic review and meta-analysis. J Clin Endocrinol Metab 99:2327–2336 PMID: 24780061
59. Maalmi H, Ordóñez-Mena JM, Schöttker B, Brenner H (2014) Serum 25-hydroxyvitamin D levels and survival in colorectal and breast cancer patients: systematic review and meta-analysis of prospective cohort studies. Eur J Cancer Oxf Engl 1990 50:1510–1521 PMID: 24582912
60. Mohr SB, Gorham ED, Kim J, Hofflich H, Cuomo RE, Garland CF (2015) Could vitamin D sufficiency improve the survival of colorectal cancer patients? J Steroid Biochem Mol Biol 148:239–244 PMID: 25533386
61. Toriola AT, Nguyen N, Scheitler-Ring K, Colditz GA (2014) Circulating 25-hydroxyvitamin D Levels and Prognosis among Cancer Patients: A Systematic Review. Cancer Epidemiol Biomarkers Prev 23:917–933 DOI: 10.1158/1055-9965.EPI-14-0053
62. Bjelakovic G, Gluud LL, Nikolova D, Whitfield K, Krstic G, Wetterslev J, Gluud C (2014) Vitamin D supplementation for prevention of cancer in adults. Cochrane Database Syst Rev CD007469 PMID: 24953955
63. Keum N, Giovannucci E (2014) Vitamin D supplements and cancer incidence and mortality: a meta-analysis. Br J Cancer 111:976–980 PMCID: PMC4150260
64. Chlebowski RT, Johnson KC, Kooperberg C, et al (2008) Calcium Plus Vitamin D Supplementation and the Risk of Breast Cancer. JNCI J Natl Cancer Inst 100:1581–1591 DOI: 10.1093/jnci/djn360
65. Baron JA, Barry EL, Mott LA, et al (2015) A Trial of Calcium and Vitamin D for the Prevention of Colorectal Adenomas. N Engl J Med 373:1519–1530 PMCID: PMC4643064
66. Lappe JM, Travers-Gustafson D, Davies KM, Recker RR, Heaney RP (2007) Vitamin D and calcium supplementation reduces cancer risk: results of a randomized trial. Am J Clin Nutr 85:1586–1591 PMID: 17556697
67. Marshall DT, Savage SJ, Garrett-Mayer E, Keane TE, Hollis BW, Horst RL, Ambrose LH, Kindy MS, Gattoni-Celli S (2012) Vitamin D3 supplementation at 4000 international units per day for one year results in a decrease of positive cores at repeat biopsy in subjects with low-risk prostate cancer under active surveillance. J Clin Endocrinol Metab 97:2315–2324 PMCID: PMC3387395
68. Chowdhury R, Kunutsor S, Vitezova A, et al (2014) Vitamin D and risk of cause specific death: systematic review and meta-analysis of observational cohort and randomised intervention studies. The BMJ. doi: 10.1136/bmj.g1903 PMCID: PMC3972416
69. Shui IM, Mondul AM, Lindström S, et al (2015) Circulating vitamin D, vitamin D-related genetic variation, and risk of fatal prostate cancer in the National Cancer Institute Breast and Prostate Cancer Cohort Consortium: Vitamin D, Genes, and Fatal Prostate Cancer. Cancer 121:1949–1956 DOI: 10.1002/cncr.29320
70. Dreyfus M, Wion D (2015) Investigating the relationship between vitamin D and cancer requires dosing the bioavailable nonhydroxylated vitamin D storage in cancer tissues. Cancer 121:3362–3363 PMID: 25990578
71. Shui IM, Mucci LA, Kraft P, et al (2012) Vitamin D-Related Genetic Variation, Plasma Vitamin D, and Risk of Lethal Prostate Cancer: A Prospective Nested Case-Control Study. JNCI J Natl Cancer Inst 104:690–699 DOI: 10.1093/jnci/djs189
72. Chen G, Kim SH, King AN, et al (2011) CYP24A1 Is an Independent Prognostic Marker of Survival in Patients with Lung Adenocarcinoma. Clin Cancer Res 17:817–826 DOI: 10.1158/1078-0432.CCR-10-1789
73. Anderson MG, Nakane M, Ruan X, Kroeger PE, Wu-Wong JR (2006) Expression of VDR and CYP24A1 mRNA in human tumors. Cancer Chemother Pharmacol 57:234–240 PMID: 16180015
74. Zhang Q, Kanterewicz B, Buch S, Petkovich M, Parise R, Beumer J, Lin Y, Diergaarde B, Hershberger PA (2012) CYP24 inhibition preserves 1α,25-dihydroxyvitamin D3 anti-proliferative signaling in lung cancer cells. Mol Cell Endocrinol 355:153–161 PMCID: PMC3312998
75. Yee SW, Campbell MJ, Simons C (2006) Inhibition of Vitamin D3 metabolism enhances VDR signalling in androgen-independent prostate cancer cells. J Steroid Biochem Mol Biol 98:228–235 PMID: 16483768
76. Luo W, Johnson CS, Trump DL (2016) Vitamin D Signaling Modulators in Cancer Therapy. Vitam Horm 100:433–472 PMID: 26827962
77. Hendrickson WK, Flavin R, Kasperzyk JL, et al (2011) Vitamin D Receptor Protein Expression in Tumor Tissue and Prostate Cancer Progression. J Clin Oncol 29:2378–2385 DOI: 10.1200/JCO.2010.30.9880
78. Lopes N, Sousa B, Martins D, Gomes M, Vieira D, Veronese LA, Milanezi F, Paredes J, Costa JL, Schmitt F (2010) Alterations in Vitamin D signalling and metabolic pathways in breast cancer progression: a study of VDR, CYP27B1 and CYP24A1 expression in benign and malignant breast lesions Vitamin D pathways unbalanced in breast lesions. BMC Cancer. doi: 10.1186/1471-2407-10-483 DOI: 10.1186/1471-2407-10-483
79. Brożyna AA, Jozwicki W, Janjetovic Z, Slominski AT (2011) Expression of vitamin D receptor (VDR) decreases during progression of pigmented skin lesions. Hum Pathol 42:618–631 PMCID: PMC3078192
80. Bhatia V, Falzon M (2015) Restoration of the anti-proliferative and anti-migratory effects of 1,25-dihydroxyvitamin D by silibinin in vitamin D-resistant colon cancer cells. Cancer Lett 362:199–207 PMCID: PMC4419377
81. Ingles SA, Ross RK, Yu MC, Haile RW, Irvine RA, La Pera G, Coetzee GA (1997) Association of Prostate Cancer Risk With Genetic Polymorphisms in Vitamin D Receptor and Androgen Receptor. JNCI J Natl Cancer Inst 89:166–170 DOI: 10.1093/jnci/89.2.166
82. Chen L, Davey Smith G, Evans DM, et al (2009) Genetic Variants in the Vitamin D Receptor Are Associated with Advanced Prostate Cancer at Diagnosis: Findings from the Prostate Testing for Cancer and Treatment Study and a Systematic Review. Cancer Epidemiol Biomarkers Prev 18:2874–2881 DOI: 10.1158/1055-9965.EPI-09-0544
83. Touvier M, Chan DSM, Lau R, Aune D, Vieira R, Greenwood DC, Kampman E, Riboli E, Hercberg S, Norat T (2011) Meta-analyses of vitamin D intake, 25-hydroxyvitamin D status, vitamin D receptor polymorphisms, and colorectal cancer risk. Cancer Epidemiol Biomark Prev Publ Am Assoc Cancer Res Cosponsored Am Soc Prev Oncol 20:1003–1016 PMID: 21378269
84. Serrano D, Gnagnarella P, Raimondi S, Gandini S (2016) Meta-analysis on vitamin D receptor and cancer risk: focus on the role of TaqI, ApaI, and Cdx2 polymorphisms. Eur J Cancer Prev 25:85–96 PMCID: PMC4885539
85. Mondul AM, Weinstein SJ, Virtamo J, Albanes D (2012) Influence of vitamin D binding protein on the association between circulating vitamin D and risk of bladder cancer. Br J Cancer 107:1589–1594 PMCID: PMC3493763
86. Chun RF, Peercy BE, Orwoll ES, Nielson CM, Adams JS, Hewison M (2014) Vitamin D and DBP: The free hormone hypothesis revisited. J Steroid Biochem Mol Biol 144PA:132–137 PMCID: PMC3976473
87. Weinstein SJ, Stolzenberg-Solomon RZ, Kopp W, Rager H, Virtamo J, Albanes D (2012) Impact of Circulating Vitamin D Binding Protein Levels on the Association between 25-Hydroxyvitamin D and Pancreatic Cancer Risk: A Nested Case-Control Study. Cancer Res 72:1190–1198 DOI: 10.1158/0008-5472.CAN-11-2950
88. Yamamoto N, Suyama H, Yamamoto N (2008) Immunotherapy for Prostate Cancer with Gc Protein-Derived Macrophage-Activating Factor, GcMAF. Transl Oncol 1:65–72 PMCID: PMC2510818
89. Inui T, Amitani H, Kubo K, Kuchiike D, Uto Y, Nishikata T, Mette M (2016) Case Report: A Non-small Cell Lung Cancer Patient Treated with GcMAF, Sonodynamic Therapy and Tumor Treating Fields. Anticancer Res 36:3767–3770 PMID: 27354652
90. Inui T, Kuchiike D, Kubo K, Mette M, Uto Y, Hori H, Sakamoto N (2013) Clinical Experience of Integrative Cancer Immunotherapy with GcMAF. Anticancer Res 33:2917–2919 PMID: 23780980
91. Matamoros ME (2017) GcMAF: a polemic or a highly promising molecule? World Sci News 20–36
92. Turner AM, McGowan L, Millen A, et al (2013) Circulating DBP level and prognosis in operated lung cancer: an exploration of pathophysiology. Eur Respir J 41:410–416 DOI: 10.1183/09031936.00002912
93. Jorde R, Schirmer H, Wilsgaard T, Bøgeberg Mathiesen E, Njølstad I, Løchen M-L, Joakimsen RM, Grimnes G (2015) The DBP Phenotype Gc-1f/Gc-1f Is Associated with Reduced Risk of Cancer. The Tromsø Study. PLOS ONE 10:e0126359 DOI: 10.1371/journal.pone.0126359